治疗实体瘤的T细胞双抗获得FDA批准进入临床
近日,CytomX Therapeutics宣布,美国食品药品监督管理局(FDA)已经批准了该公司T细胞导向双特异性抗体CX-904的研究性新药(IND)申请,旨在在肿瘤微环境中选择性地结合癌细胞上的EGFR受体和T细胞上的CD3受体,以引导具有细胞毒性的T细胞攻击癌细胞。
早在2017年,Amgen就与CytomX Therapeutics达成战略合作协议,共同开发T细胞导向的双抗平台Probody,针对癌细胞进行治疗。如果该平台包括CX-904在内的药物研发进展一切顺利,CytomX有望获得高达15亿美元的资金。
X-904就是一种条件激活的T细胞双特异性抗体结合T细胞的双特异性抗体,通过引导T细胞对抗表皮生长因子受体(EGFR)的肿瘤抗原,具有治疗实体瘤的巨大潜力。CX-904同时还将结合一种肽以减少同健康组织的结合,并预防副作用。这意味着它可以瞄准存在于健康细胞且与肿瘤相关的抗原。
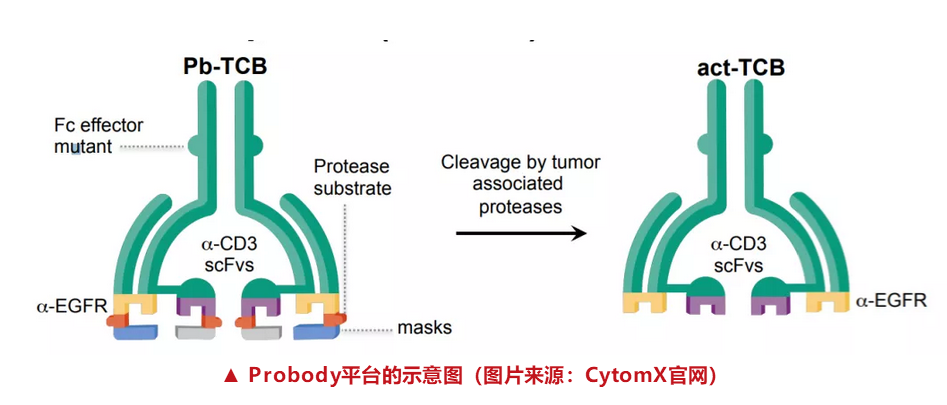
“CX-904设计的令人印象深刻的创新及其在临床环境中的进步突显了我们以不同方式摧毁癌症的承诺。CX-904的IND还标志着从我们多功能和可调节的Probody平台进入临床的第六个治疗候选药物和第三种治疗方式,加强了我们在有条件激活生物疗法领域的领导地位,”CytomX的首席执行官兼董事长Sean McCarthy说,“我们渴望启动CX-904的1期剂量递增研究,作为我们为晚期实体瘤患者带来条件激活双特异性药物的广泛努力的前沿。”
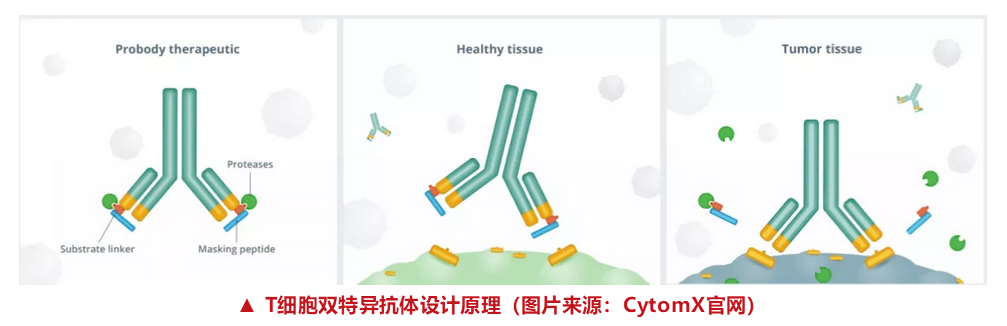
T细胞双特异性抗体(TEB)是一类新型癌症免疫治疗药物,相较于传统免疫治疗,可显著改善临床疗效和安全性。T细胞双特异抗体同时结合肿瘤细胞表面抗原和T细胞CD3受体结合,激活后者并将其物理交联到靶细胞,从而发挥抗肿瘤活性。
这种综合免疫方法特别有利于针对免疫原性较低、缺乏新抗原的肿瘤,因为T细胞可以不受其受体特异性的影响而被招募和激活。与传统免疫治疗相比,这种严格的肿瘤靶向免疫调节也有望减少全身性炎症毒性。
作为抗癌的最强大的效应机制之一,TEB在一些血液瘤中已经取得了非常有希望的早期临床数据(比如REGN1979和Roche的CD20-TCB),预计在不久的将来就会被FDA批准。
本篇内容来源为第三方转载,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。