据报导,SARS-CoV-2的感染需要许多受体和蛋白酶。在感染期间,SARS-CoV-2刺突(S)蛋白与细胞表面表达的血管紧张素转换酶2(ACE2)结合,并被跨膜蛋白酶丝氨酸2(TMPRSS2)等蛋白酶切割,导致S蛋白分裂为S1和S2结构域。SARS-CoV-2通过S2结构域融合和侵入细胞。因此,SARS-CoV-2感染被认为是依赖于宿主细胞中ACE2和TMPRSS2的表达。然而,除了ACE2和TMPRSS2之外的其他蛋白分子也在SARS-CoV-2感染中起着重要作用。
近期,有研究学者通过通过CRISPR/Cas9基因编辑系统和表达ACE2的人类诱导多能干细胞(iPS)检测了神经纤毛蛋白-1(NRP1)、碱性蛋白BSG、跨膜丝氨酸蛋白酶(TMPRSS)和组织蛋白酶(CTS)在SARS-CoV-2感染中的作用。该研究发现双重敲降TMPRSS2和组织蛋白酶B(CTSB)可将病毒载量降低至0.036%±0.021%。CTPB抑制剂CA-074甲酯和TMPRSS2抑制剂Camostat的组合更将病毒载量降低至0.0078%±0.0057%。这些研究结果都在四种SARS-CoV-2的变异株(β.1.3、β.1.1.7、β.1.351和β.1.1.248)中得到证实。同时使用这两种药物都可将人类男性和女性iPS中的病毒载量降低到0.01%以下。 这些发现表明,对于TMPRSS2和CTSB的靶向化合物表现出高效的抗病毒效果,这可以为COVID-19的治疗药物研发提供一种思路。
为了阐明除ACE2以外的受体和蛋白酶在SARS-CoV-2感染中的功能,该研究通过使用过表达ACE2的iPS(ACE2 iPS)和CRISPRi系统抑制了BSG、CTSB和TMPRSS2基因的表达水平,并设计了针对这些基因的sgRNA。用表达sgRNAs、mKate2和抗病毒基因的质粒电转染iPS,如下图所示。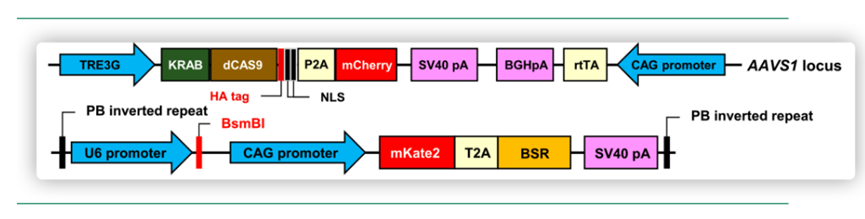
在比较通过dCas9蛋白表达抑制ACE2的iPS中目标基因的表达水平后,对细胞进行SARS-CoV-2感染,如下图所示。
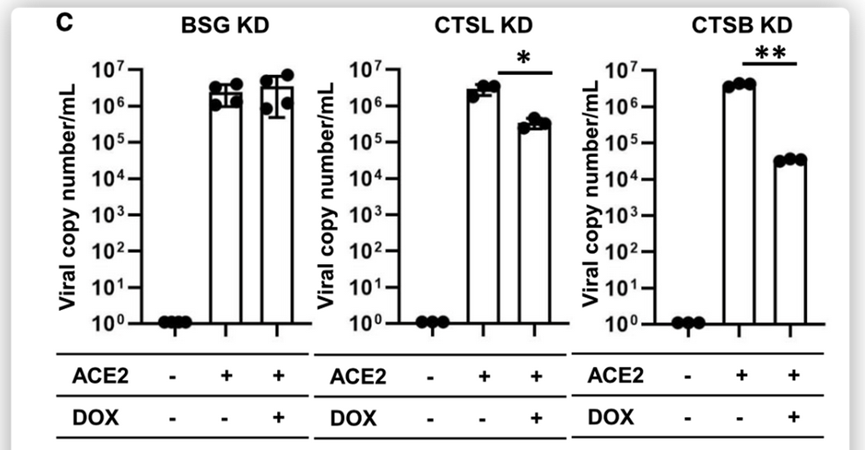
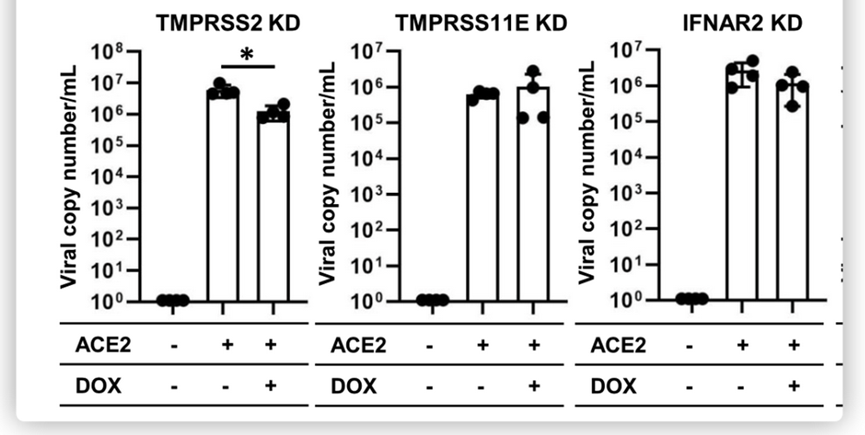 结果发现CTSL、CTSB和TMPRSS2的抑制使得ACE2 iPS中的病毒RNA拷贝数分别降低至11.7%±3.77%、0.84%±0.062%和20.6%±10.4%。TMRPSS2的抑制始终减少了刺突(S)蛋白的ACE2 iPS的数量。这些结果表明,CTSB、CTSL和TMPRSS2参与了ACE2 iPS的SARS-CoV-2感染。
结果发现CTSL、CTSB和TMPRSS2的抑制使得ACE2 iPS中的病毒RNA拷贝数分别降低至11.7%±3.77%、0.84%±0.062%和20.6%±10.4%。TMRPSS2的抑制始终减少了刺突(S)蛋白的ACE2 iPS的数量。这些结果表明,CTSB、CTSL和TMPRSS2参与了ACE2 iPS的SARS-CoV-2感染。
基于上述发现,该研究团队接下来探究了CTSB、CTSL和TMPRSS2抑制剂是否能抑制ACE2 iPS中的SARS-CoV-2感染。用SARS-CoV-2感染表达ACE2的iPS后,细胞在CA-074甲酯(CA-074 Me,CTSB抑制剂)、Z-Phe-Tyr(tBu)-重氮乙基酮(CTSL抑制剂)、卡莫司他(TMPRSS2抑制剂)或纳法莫司他(TMPRSS2抑制剂)的存在下培养,如下图所示。
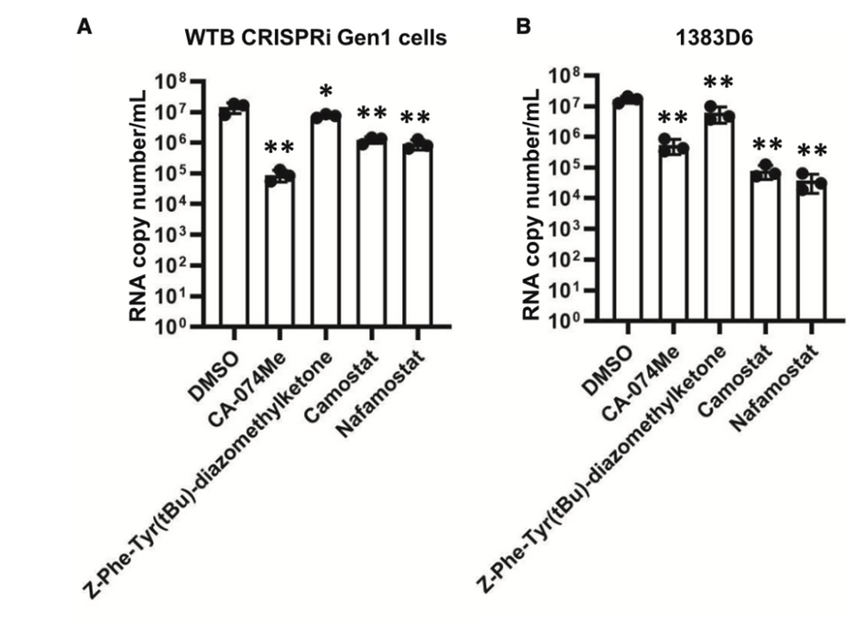
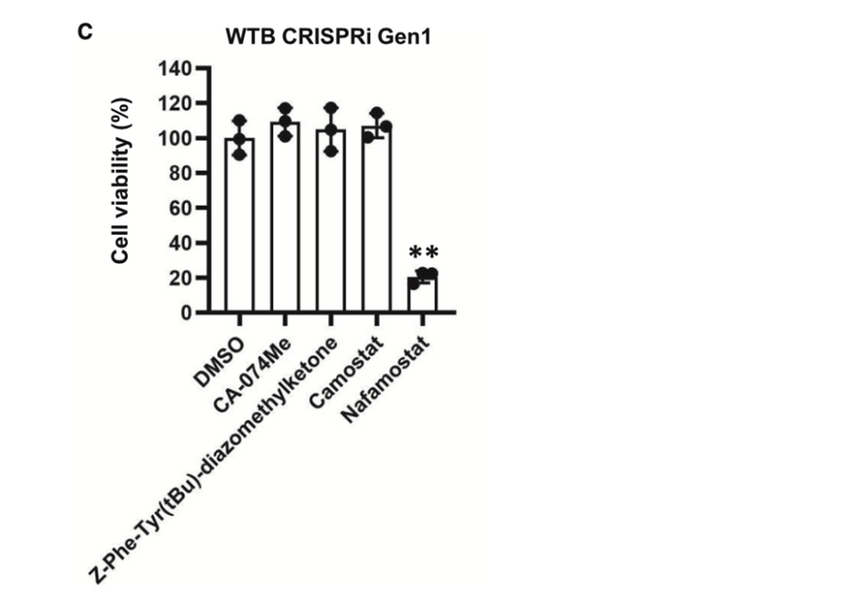
结果发现在表达ACE2的WTB CRISPRi Gen1细胞中,经CA-074 Me处理后,病毒RNA的拷贝数减少至0.62%±0.25%。在表达ACE2的1383D6细胞中,通过Camostat和Nafamostat处理,病毒RNA拷贝数分别减少至0.48%±0.023%和0.23%±0.14%。在这四种化合物中,Nafamostat对ACE2 iPS具有细胞毒性。这些结果表明,CA-074 Me或Camostat治疗可降低ACE2 iPS中SARS-CoV-2的感染效率。
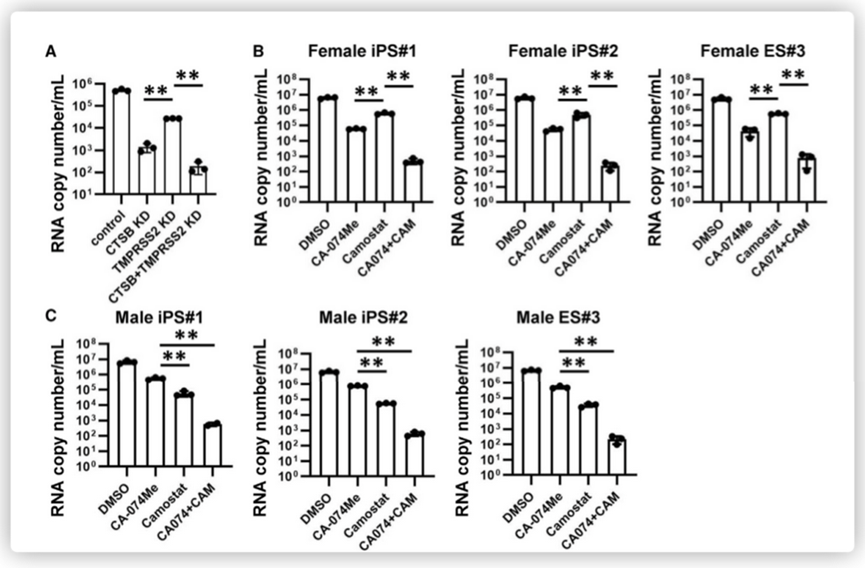
最后,该研究团队检测了TMRPSS2和CTSB的双重敲降机制对于ACE2 iPS的SARS-CoV-2感染的影响作用。结果发现,感染的CTSB和TMPRSS2双基因敲降细胞中的病毒RNA拷贝数低于感染的单基因敲降细胞中的病毒RNA拷贝数,如下图所示。
CRISPR/Cas9基因编辑系统可以使用转录阻遏物结构域(KRAB)和短引导RNA(sgRNA)融合的降解蛋白Cas9(dCas9)选择性地抑制靶基因的表达。CRISPRi和iPS的组合可以将靶基因的表达抑制到1%或更低。此外,在由iPS诱导的体细胞中,该表达也保持低水平。到目前为止,利用iPS衍生的体细胞进行的SARS-CoV-2研究已得到广泛开展。
本篇内容来源为第三方转载,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


 结果发现CTSL、CTSB和TMPRSS2的抑制使得ACE2 iPS中的病毒RNA拷贝数分别降低至11.7%±3.77%、0.84%±0.062%和20.6%±10.4%。TMRPSS2的抑制始终减少了刺突(S)蛋白的ACE2 iPS的数量。这些结果表明,CTSB、CTSL和TMPRSS2参与了ACE2 iPS的SARS-CoV-2感染。
结果发现CTSL、CTSB和TMPRSS2的抑制使得ACE2 iPS中的病毒RNA拷贝数分别降低至11.7%±3.77%、0.84%±0.062%和20.6%±10.4%。TMRPSS2的抑制始终减少了刺突(S)蛋白的ACE2 iPS的数量。这些结果表明,CTSB、CTSL和TMPRSS2参与了ACE2 iPS的SARS-CoV-2感染。

