治疗实体瘤!首款国产FRα ADC新药获批临床
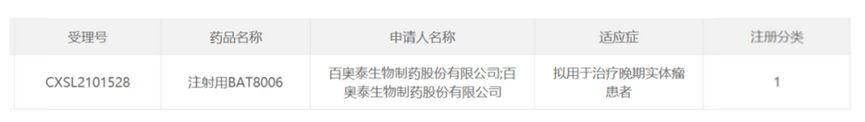
2022年3月9日,据国家药监局药品审查中心(CDE)官网公示,百奥泰注射用BAT8006的临床试验申请获得国家食品药品监督管理局(NMPA)的默示许可,用于治疗晚期实体瘤患者。根据公开资料显示,BAT8006为靶向叶酸受体α(FRα)的抗体偶联药物(ADC)。
BAT8006由重组人源化抗FRα抗体与毒性小分子拓扑异构酶I抑制剂,通过自主研发的可剪切连接子连接而成。BAT8006具有高效的抗肿瘤活性,毒素小分子有很强的细胞膜渗透能力,在ADC杀伤癌细胞后能释放并杀死附近的癌细胞,产生旁观者效应,有效克服肿瘤细胞的异质性。
同时,BAT8006具有很好的稳定性和安全性,血浆中释放的毒素小分子极低,降低了脱靶毒性的风险。BAT8006体内外药理研究中都表现出高效的抗肿瘤活性,是一款潜在的靶向叶酸受体α的“best-in-class”抗体偶联药物。
FRα在卵巢癌、子宫内膜癌、乳腺癌和非小细胞肺癌等肿瘤组织中高表达,在正常组织中不表达或者表达量非常低。
FRα作为有明确成药可能且竞争较少但的ADC靶点,可避免同质化竞争,具有差异化优势。目前全球尚无靶向FRα的ADC产品获批上市,临床阶段的ADC产品尚为少数,但已经受到了一些制药巨头的看好。
2021年6月,卫材(Eisai)和百时美施贵宝(BMS)共同宣布,双方达成全球性合作协议,将共同开发和商业化在研的FRα ADC药物MORAb-202。根据协议,卫材将获得6.5亿美元的前期付款和可达24.5亿美元的里程碑付款。
2012年12月,天士力宣布与美国Sutro Biopharma达成合作,获得靶向FRα的ADC药物STRO-002在中国大陆及港澳台的独家开发和商业化权益。
新一代ADC产品STRO-002使用的无细胞蛋白合成技术,并通过非天然氨基酸进行ADC定点偶联技术,有望解决传统ADC非定点偶联所造成的产品在药学质量和药理等方面的问题。
国内除天士力外,华东医药也引进了一款FRα ADC,IMGN853(Mirvetuximab Soravtansine),来自美国ImmunoGen,华东医药获得IMGN853在大中华区的独家临床开发及商业化权益。不久前,华东医药与合作伙伴ImmunoGen共同宣布IMGN853的美国关键性3期临床试验达到主要研究终点,预计2022年第一季度在美国递交IMGN853的BLA申请。
本篇内容来源为第三方转载,本网所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。